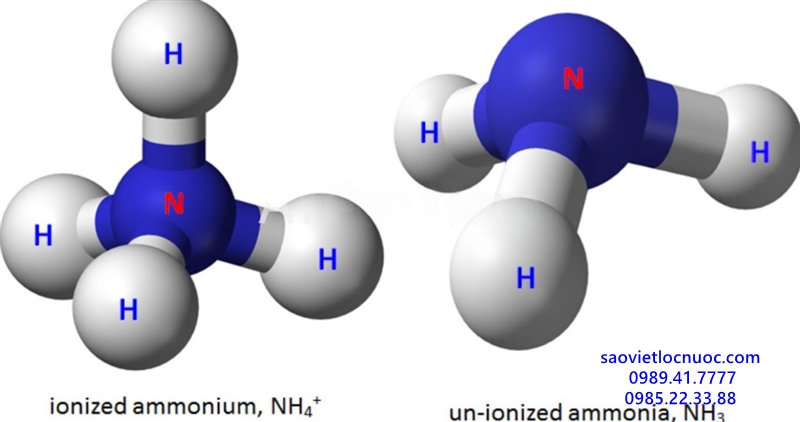
Phân biệt amoniac và amoni
Amoniac và amoni đều là các hợp chất của nito với hydro tuy nhiên chúng không giống nhau. Bài viết này giúp bạn tìm hiểu amoniac và amoni và sự khác biệt giữa chúng.
Amoniac và amoni
Amoniac có công thức NH3 là chất khí không màu, có mùi khó chịu mạnh. Amoniac là nguyên liệu hóa học quan trọng được sử dụng để sản xuất phân bón, sản phẩm tẩy rửa, nhựa, thuốc trừ sâu và chất nổ. Amoniac còn có tác dụng giúp cây cố định đạm. Amoniac không bị ion hóa và gây độc cho sinh vật dưới nước.
Amoniac được điều chế bằng cách tổng hợp nito và hydro: N2 + 3H2 ↔ 3 NH3
Đối với hồ bơi, amoniac từ nước tiểu của người bơi kết hợp với clo tạo thành chloramine làm hồ bơi mùi clo nồng nặc, gây cay mắt mũi và khó chịu.
Amoni công thức NH4+ là một ion, bao gồm một nguyên tử nito và bốn nguyên tử hydro. Amoni tích điện dương do đó nó có thể kết hợp với các ion tích điện âm để tạo thành muối. Ion amoni là chất dinh dưỡng quan trọng trong đất và là nguồn dinh dưỡng quan trọng cho nhiều loài thực vật và động vật. Amoni có trong nhiều loại muối như amoni clorua, amoni cacbonat, amoni nitrat. Hầu hết các muối amoni đều hòa tan trong nước. Amoni cũng được sử dụng trong sản xuất phân bón và chất nổ. Ngoài ra nó cũng được sử dụng trong chất đẩy tên lửa, bộ lọc nước và trong chất bảo quản thực phẩm. Amoni bị ion hóa và về cơ bản không gây hại cho sinh vật dưới nước.
Mối liên hệ giữa amoniac và amoni
Amoniac phản ứng với nước tạo thành ion amoni và ion hydroxyl
NH3 + H2O ↔ NH4+ + OH
Trong nước yếu tố chính quyết định tỷ lệ amoniac và amoni là độ PH của nước. Khi độ PH thấp phản ứng sẽ bị đẩy sang phải và khi độ PH cao phản ứng bị đẩy sang bên trái. Nhìn chung, Amoniac không ion là dạng độc hại và chiếm ưu thế ở giá trị pH cao. Ion NH 4+ tương đối không độc và chiếm ưu thế ở giá trị pH thấp. Thông thường, ít hơn 10% amoniac ở dạng độc hại ở giá trị pH nhỏ hơn 8,0. Tỷ lệ này tăng đáng kể khi tăng độ pH. Sự cân bằng giữa NH 3 và NH 4+ cũng bị ảnh hưởng bởi nhiệt độ. Ở bất kỳ độ pH nào, nước lạnh hơn sẽ có nhiều amoniac độc hại hơn.
Sự khác biệt giữa amoniac và amoni
Amoniac là một bazo yếu và không bị ion hóa trong khi Amoni bị ion hóa. Amoniac có mùi nồng nặc trong khi amoni không có mùi.
Amoniac gây độc cho sinh vật dưới nước còn amoni không gây hại đối với sinh vật dưới nước.
Có thể gặp amoniac nguyên chất không có amoni nguyên chất.
Amoniac khi hòa tan trong nước tạo thành dung dịch amoniac và khi tiếp xúc với không khí nó trở thành khí. Nếu amoniac phản ứng với nước một phần sẽ trở thành amoni. Dung dịch muối amoni đậm đặc khi được xử lý bằng bazo mạnh sẽ tạo ra amoniac